
Secciones
Servicios
Destacamos

Raquel Merino y EP
Málaga
Domingo, 26 de marzo 2023, 15:13
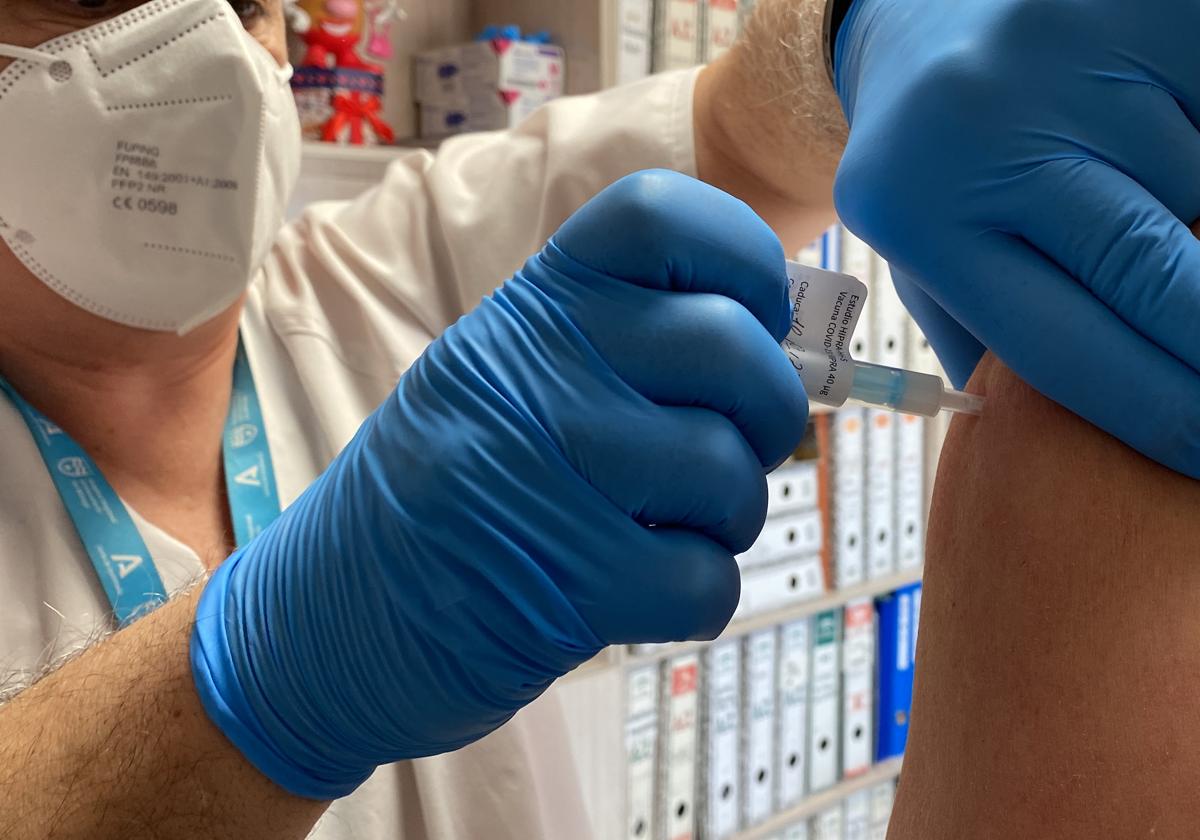
Parece que la distribución en la Unión Europea de la vacuna española contra el Covid de HIPRA está cada vez más cerca. El Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) ha iniciado la evaluación ... de la autorización de comercialización de la vacuna, que llegará al mercado con el nombre de 'Bimervax'.
En julio del año pasado, la ministra de Ciencia e Innovación, Diana Morant, ya manifestó que esperaban que en «pocos días» la EMA emitiría su opinión sobre este inyectable y las posibilidades de que se autorizara su distribución en Europa en breve. De hecho, desde la propia compañía se esperaba recibir luz verde para su registro y comercialización en noviembre y poder distribuir las primeras dosis a los Estados miembros antes de que acabara 2022.
Sin embargo, esta decisión se retrasó después de que el comité de la EMA solicitara a HIPRA datos adicionales sobre la calidad del proceso de fabricación. Como la misma ministra comentó el pasado mes de enero, «lo cierto es que la EMA está siendo muy exigente, creo que como ahora ya hay vacunas no estamos en el mismo momento, pero hoy los tiempos son los tiempos de la EMA y no nos cabe otra cosa que respeto».
En cualquier caso, tanto desde HIPRA como desde el Gobierno han defendido siempre la utilidad de la vacuna. La ministra afirmó que lo que están haciendo es trabajar con la farmaceútica, cuya vacuna «es muy buena» y está presentando «muy buenos resultados» y todos los ensayos clínicos «están yendo bien».
A finales de 2022, se inició el proceso de revisión continuada o 'rolling reveew' de la vacuna, paso previo para autorizar su comercialización. En esta fase de ensayos clínicos -en el que participó el Hospital Regional de Málaga- se evaluó la inmunogenicidad y la seguridad de esta profilaxis como cuarta dosis contra el Covid en personas vacunadas previamente con tres dosis de la vacuna Comirnaty (Pfizer) o con dos dosis de la vacuna Comirnaty más el booster de la vacuna de Hipra, que se administró en el marco del ensayo clínico anterior de fase 2B.
Ahora, solo queda esperar que el Comité de Medicamentos de Uso Humano de la EMA recomiende en su reunión mensual, que se celebra la semana que viene, la aprobación de la vacuna. De este modo, en horas o días, la Comisión Europea podría ratificarla y dar luz verde a la distribución del inyectable 'Bimervax' de HIPRA.
A diferencia de las vacunas de ARN mensajero de Pfizer y Moderna, 'Bimervax' se basa en dos proteínas recombinantes capaz de generar una respuesta frente a una de las proteínas del virus SARS-CoV-2 conocida como proteína S (de spike, llamada proteína espiga en español). Este tipo de vacuna de proteína recombinante -de la que hay mucha experiencia en vacunas ampliamente utilizadas en la población (gripe, hepatitis A o papiloma, entre otras)- permite «hacer pequeños cambios de forma rápida» por lo que puede adaptarse rápidamente ante posibles nuevas cepas del Covid.
Otra de las ventajas de HIPRA es que no requiere para su conservación de temperaturas bajo cero, sino que las dosis se pueden mantener entre 2 y 8 grados, lo que facilita su almacenamiento y distribución.
¿Ya eres suscriptor/a? Inicia sesión
Publicidad
Publicidad
Te puede interesar
Publicidad
Publicidad
Esta funcionalidad es exclusiva para suscriptores.
Reporta un error en esta noticia
Comentar es una ventaja exclusiva para suscriptores
¿Ya eres suscriptor?
Inicia sesiónNecesitas ser suscriptor para poder votar.